ポストゲノムプロジェクトとプロテオーム解析
ヒトゲノムプロジェクトが終了し,様々なヒト遺伝子群が解明され,医学など多くの分野での利用が期待されています.しかし,ゲノムの全配列が解読され,病気の原因となる遺伝子がわかったとしてもそれで完全に病気を防げるわけではありません.つまり,病気というものはその遺伝子が作るタンパク質と,それに関わっているたくさんのタンパク質が細胞の中で様々に関与しながら病気という現象を作り出しているからです.
このように,タンパク質の設計図としての遺伝子の解析とは別に,細胞内で発現されているすべてのタンパク質を網羅的に解析し,生物活動にどのような制御が行われているのかを調べていくことが重要となってくることを示しています.近年このような背景の中で,遺伝子におけるゲノムに対応する言葉としてプロテオームという言葉が使われるようになってきました.すなわちプロテオームとは,上記のように,細胞内で発現されているすべてのタンパク質を意味します.
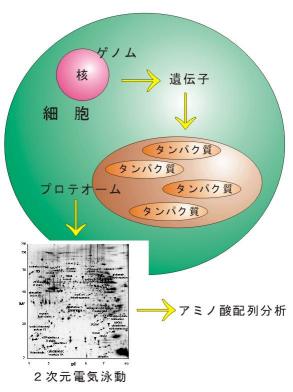
プロテオームを解析するためには非常に多数の試料を,微量でかつ迅速に分析する必要があります.現在用いられている一般的な方法は,組織や細胞から抽出した試料について,2次元電気泳動という分離方法で個々のタンパク質を分離し,マップを作ることです.例えば,ヒトの肝臓の2次元電気泳動マップを作り,検出された個々のタンパク質の場所を調べておけば,正常な場合とある病気を持った場合のマップを比較することで,その病気に関わるタンパク質を特定することができるのです.そしてそのタンパク質の構造を調べて,ゲノムデータベースで検索すると,どの遺伝子から作られたタンパク質であるかを知ることができます.
最近ではインターネットとの接続で直接タンパク質の構造解析をしなくても目的とするタンパク質が何者であるかがすぐわかるように2次元電気泳動のデータベースが作成されつつあります(Swiss Institute of Bioinformatics: ExPASy server (http://expasy.nhri.org.tw/ch2d/)).このデータベースでは2次元電気泳動マップのタンパク質をクリックするとそのタンパク質の情報が表示されるようになっています.
生体の中では,遺伝子から作られたタンパク質は,ほとんどが翻訳後修飾という,加工を施されて実際に機能するタンパク質になっています.したがって,遺伝情報だけではなく,実際に働いているタンパク質を調べることが,ゲノム解析が終了しつつある今日において重要となってきているのです.
東海大学タンパク質化学研究室では,応用動物科学科や熊本大学医学部と共同で動物や人の病気に関わる原因タンパク質を解明するプロジェクトの中でこのプロテオーム解析を行っています.
癌のプロテオーム解析 (熊本大学医学部腫瘍医学教室との共同研究)
多くの癌は,発癌関連遺伝子の欠失や変異で起こっています.癌関連遺伝子が作る蛋白質のほとんどが,ヒト細胞内の細胞周期や細胞死や分化のシグナルに必要不可欠な役割を果たしていると考えられています.そしてこれらは,リン酸化やプロテオリシスのような翻訳後修飾や,様々な生理活性分子群とのシークエンシャルな相互作用のクロストークネットワークにより機能制御されています.癌のプロテオームは,これらの遺伝子産物が関与する如何なる細胞内蛋白質群の機能変化が,何時,どこで,どの様にして,正常の細胞活動を破綻させ,癌をprogressさせて行くのかを,各組織・細胞で網羅的かつ系統的に整理し,ゲノム解析の情報と併せて,合理的な治療法や癌マーカーや予防法の開発に役立てることを目的としています.
I. 最近の癌研究の流れ
癌の研究はここ18年ほど,発癌に関連する遺伝子を発見することに集中していたと言っても過言ではないでしょう.Weinbergらが,1982年にRasがヒト膀胱癌で点突然変異によって活性化されoncogeneとして働いているという発見をし2),さらに,1986年にヒト網膜芽細胞腫の原因遺伝子RBが腫瘍抑制遺伝子として初めて同定されて以来3),100を越える癌関連遺伝子が発見されています.さらに今後のゲノム解析で新しい遺伝子が同定され,ますますその数は増加してくるでしょう.
これらの癌関連遺伝子の作る蛋白質のほとんどが,実はヒト細胞内で細胞周期や細胞死や分化の生理的なシグナルに必要不可欠な役割を果たしていることがわかってきました.その中で,ある組織のある特定の細胞内で特に重要であり,その欠失や変異でその機能が破綻することが癌化の原因となる,いわゆるゲートキーパー(門番)と呼ばれる腫瘍抑制遺伝子群が注目されました.p53を代表とするこれらの遺伝子が作る蛋白質は,一般的にリン酸化やプロテオリシスのような翻訳後修飾によって,さらには細胞内で様々な腫瘍関連蛋白質同士や生理活性蛋白質群,特定のDNA配列とのシークエンシャルな相互作用の複雑なクロストークネットワークによって機能制御されています.これらゲートキーパー分子は,今や細胞周期チェックポイント機構やアポトーシスや分化のシグナル伝達研究の要となっており,これらを介した細胞内シグナルネットワークは一つの細胞模式図にとても書ききれないほど複雑化しています.
問題点は,これらの細胞内シグナルのマップは,しばしば個々の研究者によって興味のある分子の特別な例のみがデフォルメされて書かれていたり,組織細胞種における特異性が混同されていて曖昧であったり,明らかに時間軸を欠いているので,細胞の生物現象の全体から考えたとき,どの細胞のどこの部分で,何時,どの分子らがどの様に最も重要な働きをしているのかが,非常に整理しづらいことです.今後,このような生理的な細胞現象を,一つ一つの分子を別々に調べて分子の側から説明するのではなく,全ての細胞内発現蛋白質を網羅的に時間軸を追って解析し,如何にトータルとしての機能制御が行われて生物活動が成り立っていくのかを調べていくこと,そして,如何なる細胞内蛋白質群のどの様な変化がおきて正常の細胞活動が破綻し,癌をprogressさせて行くのか,という網羅的な情報を得ること,即ちこれらを全て含むプロテオーム解析が,癌ゲノム解析とともに特に重要になってくるのは明かです.
II. 癌ゲノムとプロテオーム
癌のゲノム解析は,癌のプロテオーム解析に多くのヒントを与えてくれています.米国国立癌研究所(NCI)が主催するゲノム研究にCGAP (Cancer Genome Anatomy Project) というプロジェクトがあります.様々な形態を持つ細胞を,遺伝子の発現で捉え直すという基本概念からなりたっており,癌細胞の場合も従来は形態の変化でとらえられてきた癌化の過程を,遺伝子の変異と発現の変化として捉えようとしており,遺伝子発現プロファイリングとしてゲノム機能解析プロジェクトで中心的な課題の一つとなっています.この研究の特徴は,癌細胞における遺伝子の発現を個々に捉えるのではなく,体系的に,網羅的に,記載しようとしているところです.この考え方はそのまま癌のプロテオーム解析のストラテジーに当てはめられています.すなわち,癌遺伝子や癌抑制遺伝子産物の蛋白の構造や機能の変化のみならず,それに連動した結果の蛋白質発現量変化や翻訳後修飾の変化を含めた全体を記載しようという考え方です.又,ヒトゲノムには塩基配列上に多くの多型が存在し,その多型によって体質や薬に対する感受性が決まっているものもあることがわかっており,その違いが個人の疾患感受性や薬剤感受性などとも関係していることから,特にSNP(single nucleotide polymorphism)解析には個人別の生態情報にもとづいた治療法(オーダーメイド医療)開発の可能性を期待されています.ヒトプロテオームでもSNPによる蛋白質の構造変化や,蛋白質の翻訳後修飾の多様性(例えば糖鎖修飾など:グライコームという言葉も使われはじめています)は蛋白質レベルの個人の多型性を反映しやすく,重要となる構造体を量的・質的にも正確に高感度で,しかもhigh throughput に同定できるような蛋白解析技術の開発によって有用となる可能性があります.
III. 癌研究に用いられているプロテーム解析のストラテジー
癌研究におけるプロテオームの解析は,未だ発展途上であり,日々改良が加えられています.一般的な方法を簡単に説明します.
1. Differential proteomic display;最も一般的に行われているのが,特定の癌組織・細胞と,その癌組織の近縁の正常部位,あるいはコントロールとなる正常個体の同等の組織・細胞を同様の方法で採取し,抽出蛋白質の2次元電気泳動(2-DE)による蛋白プロファイルの比較です.癌組織を病理学的に良性,悪性,ステージの違い,細胞種等でクラス分けし,2DEデータを解析し,特定の変化を示す蛋白質をリストアップすると共に,2-DEのパターンをプロファイル化します.これらの解析で重要な情報となるのは正常の組織細胞の2DEにおける全スポットの蛋白情報です.癌化や何らかのストレスや薬剤投与などで2DE上で変化する蛋白質をリストアップする際の大きな情報源となるのみならず,抗体を用いたWestern Blottingによるターゲット分子のプロファイル変化の解析にも威力を発揮します.その他,電気的にPVDF膜などにtransferした2DEマップは,標識した分子をプローブにして結合蛋白質の検索 (Ligand Blotting又はWest Westernの応用)や,特異的な基質に反応する酵素検索などにも応用されています.
2. ターゲット癌関連遺伝子機能に関するプロテオーム解析;ある特定の腫瘍関連遺伝子産物の細胞内機能を解析することを目的とする場合は,2つの方法でアプローチしています.一つは,ターゲットとする遺伝子が欠失,変異している特定の細胞の2DE蛋白プロファイルを作成し,正常細胞とDifferential proteomic displayを行い,変化している蛋白質をリストアップします.ターゲット遺伝子をノックアウトしたマウスの組織・細胞と,コントロールとして同腹で生まれ全く同じ遺伝的バックグラウンドを持つワイルドタイプマウスの正常組織を用いて,2DEの蛋白プロファイルの比較ができます.この際,病理学的解析データを同時に解析して参考にしながら,ストレスや薬物投与による応答の違いや,癌化のステージの変化による2DE蛋白プロファイルの変化を解析します.もう一つの方法は,ターゲット遺伝子産物に対して,相互作用する細胞内蛋白質を網羅的に解析していこうという方法です.すなわち,目的の蛋白質に結合する蛋白質を順次同定していくことによって,その蛋白質が関与する細胞内ネットワークの全てを把握することを目的とします.この場合,アフィニティー担体(ビーズ,ポリマー,膜,センサーチップなど)にターゲット遺伝子産物やそれに対する抗体,或いはリン酸化のような修飾を施したペプチド等を固相化して細胞抽出物と反応させ,これに結合する蛋白質を"いもづる式"に分離して同定してゆきます.これらの陰性コントロールに結合する蛋白質群は,非特異的結合群としてサブトラクションします.同定された特異的結合分子は,ターゲット遺伝子産物の修飾や細胞内シグナル伝達に関わる分子である可能性が高くなります.MALDI-TOF-MASSなどの質量分析機とonline化が試みられている,プロテインチップや表面プラズモン共鳴センサーチップなどは,高感度とhigh throughputの利点で本格的な実用化が期待されています.
使用しているプロテオーム解析システム

プロテオーム解析用質量分析計
API QSTAR Pulsar i
QqTOFハイブリッドLC/MS/MSシステム
■ペプチドのフラグメントイオンが比較的きれいに取れるので,ゲノムが明らかでない生物種の未知のタンパク質のデノボシークエンスに適しています.プロテインシークエンサーの代わりに使うことも可能です.

プロテオーム解析用最新型質量分析計
Applied Biosystems 4700 Proteomics Analyzer
MALDI/TOF/TOF オプティクスシステム
■感度が非常に高いので,2D−PAGEのシングルスポットからのPMF解析に適しています.トリプシンペプチドのLysペプチドはイオン化しにくいのでシークエンスタグ解析では前処理等が必要です.デノボシークエンスにはあまり適していません.しかし,東海大学タンパク質化学研究室では,このMALDI型質量分析計をデノボシークエンスに用いる手法を開発しました.非常に高感度で簡便に配列分析が可能です.

タイ国土壌中から分離したトルエン資化菌の
2次元電気泳動パターン
Home