さらに、以下にあげる項目は、これまでの成果をもとに、次の10年間のために実行している研究である。
1)内在性レトロウイルス遺伝子の存在意義とその機能解析
2)着床・胎盤形成における機能遺伝子群の新structure/function解析
3)胎盤機能付加細胞の作出とその応用
いままで多くの研究者が、再生医療を目指し「人口胎盤」の開発を試みてきたが、その作出までには至らなかった。近年、トロホブラスト細胞の融合や細胞同士の三次元構造の構築に一つの内在性レトロウイルス遺伝子(Syncitin)の役割が注目されるようになった。ところが、トロホブラスト細胞では少なくても10種類以上の内在性レトロウイルス遺伝子が発現している。これらの内在性レトロウイルスの遺伝子は、IFNt遺伝子発現の低下とともに活性化してくる事実から、現在、IFNt遺伝子発現と内在性レトロウイルス遺伝子の活性や制御の研究を行っている。
以上のことにより、着床や胎盤形成およびゲノム構造とその機能遺伝子発現制御や遺伝子機能解析を行い、哺乳類特有の胎盤機能の共通項を明らかにしていく。それを基に、胎盤機能を持つ細胞群の作出をすることとその有効利用を計画としている。
研究理念
これまで、生命は「受精」によって始まると言われていた。しかし、実際には多くの受精卵は初期胎盤の形成以前に死に至り、妊娠は成立しない。哺乳類特有の生殖形態である妊娠は、胚仔の子宮内膜への着床と胚仔由来の細胞を中心とした初期胎盤形成に始まる。胎盤は哺乳類(真獣類)で獲得された独特の器官であるが、ブタ、反芻動物(ウシ、ヒツジ)、げっ歯類や哺乳類で胎盤の構造には多くの違いがみられる。ところが、その機能は胎児発育のための物質交換機能、妊娠状態を維持するための内分泌機能、母親と異なった遺伝子を持つ胎児を免疫系から守る免疫調節機能、さらには母親と胎仔の代謝調節を司る代謝調節機構など、多種多様ではあるが哺乳類共通の機能を有している。一方、胚・胎仔の「器官」形成は、胎盤の形成と心臓・血管系が発達しないと始まらない。したがって、例えば、胎盤を構成する主な胎児由来細胞である栄養膜(トロホブラスト)細胞の発生から、着床・胎盤形成を経て分娩に至るまでの一連の過程のいずれかで「トロホブラスト-子宮内膜-胎盤機能」に異常が生じた場合、哺乳類では次世代を残すことが不可能となる。この生命が始まる一連の過程で、個々の現象で発現している遺伝子群とそのエピジェネテックスな制御はかなり同定・解析されてきた。しかしながら、着床過程を再現する実験系がないばかりではなく、胎盤構造の形成過程や胎盤機能発現とその維持に至るメカニズムは未だに解明されていない。
ゲノム全体の2%を占める、いわゆる機能遺伝子群の個々の遺伝子の改変、その発現制御や細胞融合によるレスキューから生理現象を説明しようとするのではなく、レトロトランスポゾンを含む休眠遺伝子群などゲノム全体から、リスクやベネフィット因子群を抽出し、総体としての「ゲノム構造・遺伝子発現制御・遺伝子機能」の視野から個々の現象を説明する「新しい生殖生理学」の構築を目指している。具体的には、異なる哺乳動物種の着床過程、胎盤構造や胎盤機能発現の解析を続ける。そして、着床過程や胎盤構造の違いはあっても「胎児を育む」という器官機能の同一性を踏まえ、実験動物や産業動物の着床・胎盤形成過程の様々な現象の異同を見据えていく。さらに、胎盤構造の多様性の中から共通する胎盤機能の本質を明らかにし、新たな概念を提唱しようとする次世代の研究者「Next
generation」を養成する。
インターフェロンタウ調節因子の同定
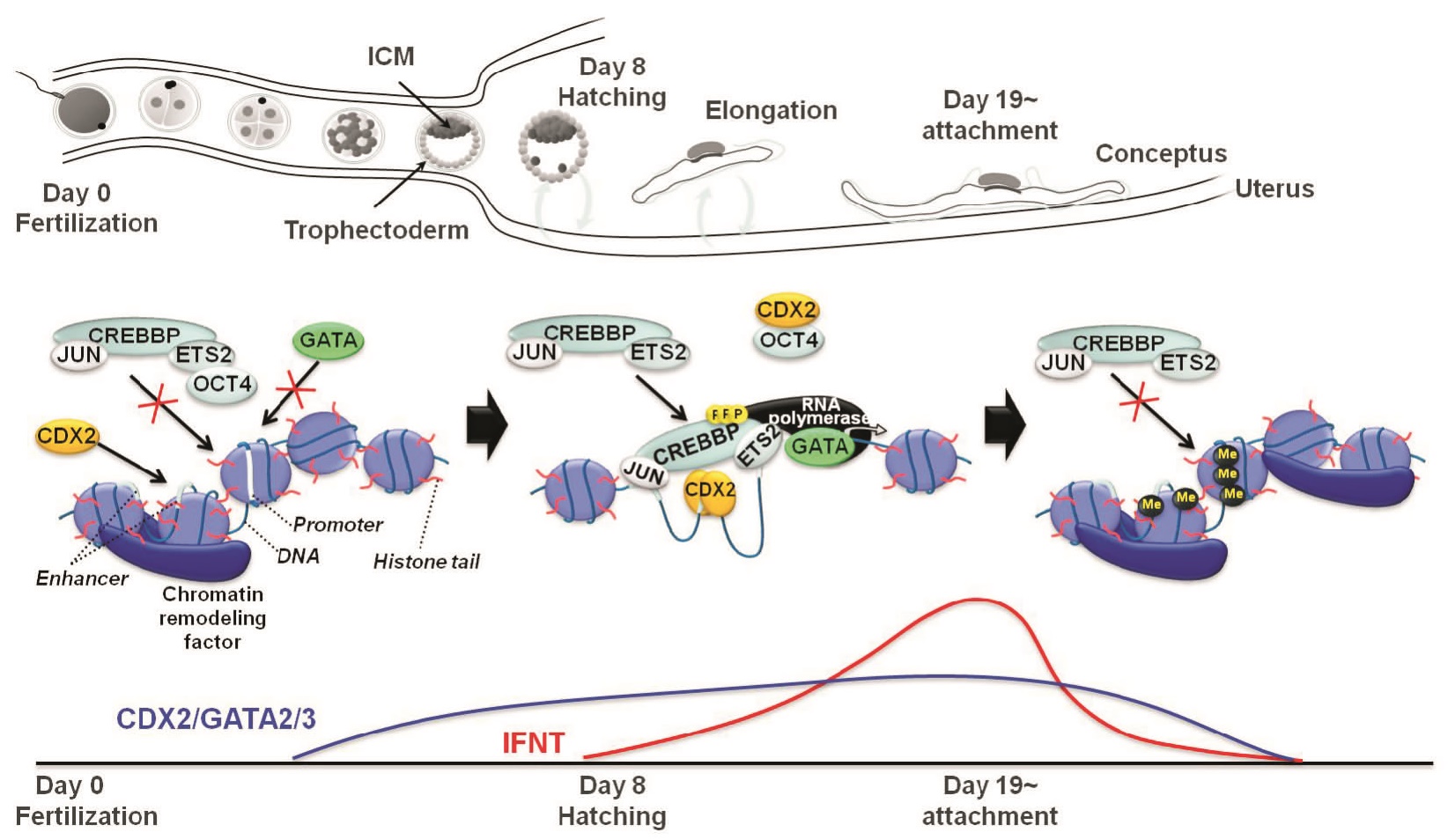
1987年に発見した反芻動物特異的な胚インターフェロン・タウ(IFNT, Imakawa et al., Nature)は孵化後の胚から分泌が開始され、子宮内膜への接着(ヒトやげっ歯類の着床にあたる)後に減少する。このIFNTは黄体の退行を抑制することで妊娠の維持に重要な役割を果たす。IFNT遺伝子の時期特異的な発現機序を明らかにする研究は世界中で盛んに行われている。しかしながら、その機構は未だ不明な点が多い。
当研究室では、IFNTの調節因子としてCDX2、GATAsやTEADが重要であることを明らかにしている(Sakurai et al., 2009 Biol Reprod; 2010 Endocrinology; Bai et al., 2009 Mol Reprod Dev; 2011 J Reprod Dev; 2012 Mol Reprod Dev;
2013 J Reprod Dev; 2014a,c Anim Sci J)。さらに、接着後のIFNT発現抑制はEOMESやYAPが調節していること報告している(Sakurai et al., 2013 Mol Reprod Dev; Kusama et al., 2016 Domest Anim Endocrinol)。また、胚の接着前後でIFNTプロモーター領域のメチル化とアセチル化がスイッチする(Sakurai et al., 2010 Endocrinology)。この遺伝子の発現を人為的に制御する方法を開発する。次に、この遺伝子発現を人為的に調節することによって、胚仔の子宮内膜への着床および初期胎盤形成のどの過程が制御・影響されるかを解析する。それによって、着床や胎盤の成立機構の理解を深め、どの過程で妊娠が「成立」または「不成立」となるのかを明らかにする。その時、胚IFNTによって発現が促進または低下する子宮側の遺伝子群の同定を行い、子宮側における着床や胎盤成立マーカー遺伝子を同定する。そして、in
vitro共培養系(Sakurai et al., 2012 Biol Reprod)でIFNTや母体側のマーカー遺伝子を制御し、in vitro系における着床過程や初期胎盤成立現象を遺伝子の発現制御から再構築する。最終的には生体における着床過程から胎盤形成までの制御を可能にしていく
胚の子宮内膜への接着機構の解明
母体(子宮内膜)の胚盤胞の許容:着床ウインドウ
ヒトの子宮内では脱落膜が排卵周期にともなって自律的に形成される。しかし、子宮内膜上皮細胞が胚子の接着を許容する(胚子の受容)時期、すなわち黄体の機能維持や着床による刺激が脱落膜を母体側胎盤として維持・増殖を誘起できる時期は、月経周期のなかのごく限られた時間帯であることが知られており、この時期は「着床ウインドウ」(implantation
window)と呼ばれている。げっ歯類においては、一過性に生ずる脱落膜形成の感受期が着床可能な時間帯であることから、この時期が着床ウインドウに相当する。他の産業動物を含む哺乳類でも、胚子が子宮に着床できる時期が限られており、一過性の着床ウインドウの存在が知られている。着床ウインドウ期のマーカー遺伝子群やそれらの発現制御機構は明らかにされつつあるが、その成立機構そのものはヒトやげっ歯類と同様に明確にはされていない。
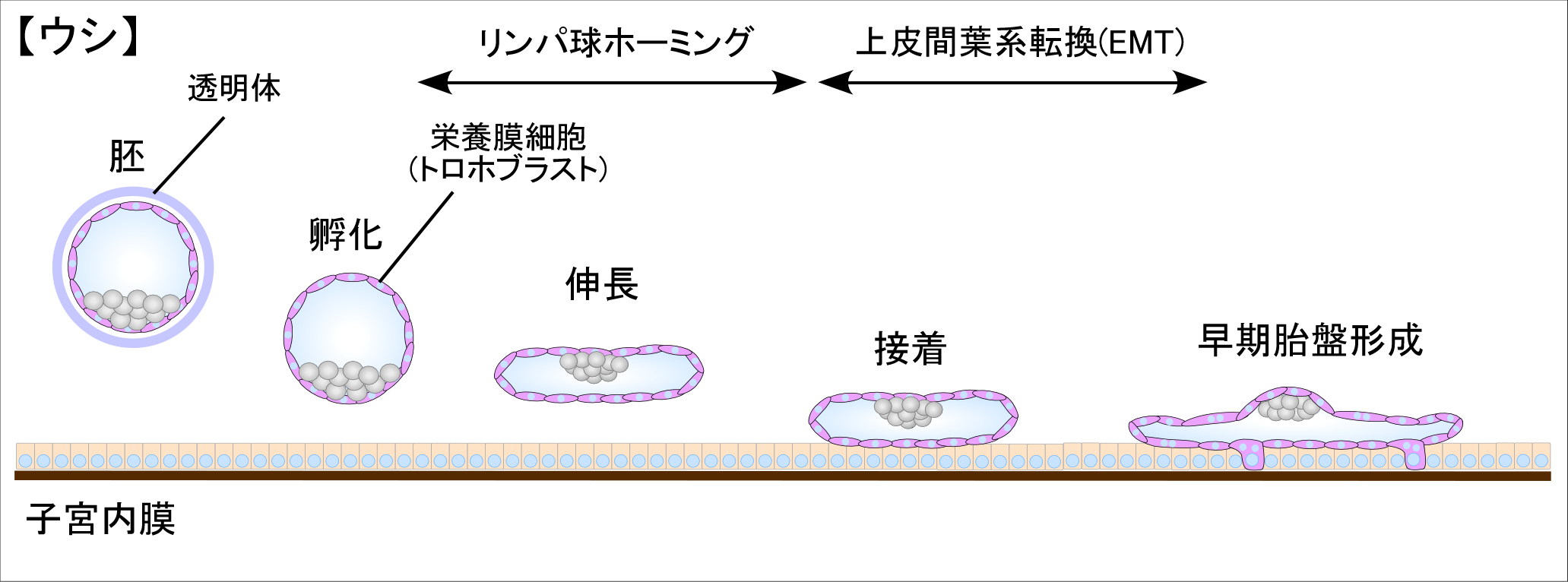
トロホブラスト細胞と子宮上皮細胞の接着~胎盤形成機構:新知見
リンパ球ホーミング
リンパ球ホーミングとは、血液中のリンパ球が血管から炎症部位に遊走する機構をいう。そこではリンパ球の減速、血管内皮細胞への接着と浸潤が関わっており、近年、それらの機構が胚と子宮内膜の接着にも使われていることが明らかになってきた。実際、リンパ球の減速に関与するセレクチンはヒト胚盤胞のみならず、他の動物種にも存在している。ウシではセレクチンは子宮内膜側に発現しており、胚側のレセプターとのインターアクションにより子宮腔中の胚の減速に寄与している(Bai et al., 2015 Biol Reprod)。さらにウシでは、リンパ球ホーミングの後期に必須なVCAM-1が胚トロホブラストと子宮上皮細胞の両方に発現している。しかし、そのレセプターのインテグリン・アルファ4(ITGA4)は胚トロホブラスト細胞上にのみ発現している。この両者のインターアクションでウシ胚は子宮上皮細胞へ接着する(Bai et al., 2014 Reproduction)。
上皮間葉系転換(Epithelial-Mesenchymal Transition, EMT)
上皮間葉系転換(EMT)は癌細胞転移のメカニズムとして知られるほか、原腸形成を初めとする発生時の様々な形態形成過程でもみられる現象である。通常、生体における上皮細胞同士の頂上面は接着性を持たないため、胚盤胞において上皮細胞様の形質をもつトロホブラスト細胞と子宮内膜上皮細胞の頂上面同士による上皮細胞同士の接着という現象も生物学的パラドックスの一つとして捉えられてきた。当研究室ではEMTという現象に着目し、トロホブラスト細胞が間葉系の性質を獲得することでその頂上面に接着性を獲得すると考えた。
実際、伸長するウシ胚では上皮細胞マーカーのサイトケラチン(cytokeratin)と間葉系細胞マーカーのビメンチン(VIM)を共発現しており、形態的には上皮であるはずのトロホブラスト細胞が間葉系細胞でもあることを示していた。また、機能としてトロホブラスト細胞は上皮に見られるE-cadherinではなく、間葉系細胞に特徴的なN-cadherinを発現(E-cadherinからN-cadherinへの発現転換:カドヘリン・スイッチング)していた。このことは、ウシ・トロホブラスト細胞は着床期に上皮細胞でありながら間葉系細胞(EMT)に特徴的な遺伝子発現をしていたことになる。さらに、接着開始2~3日後の妊娠22日齢のウシ胚においてEMT関連転写因子群の発現上昇が見られ、着床期のウシ胚でのEMTはこれらの転写因子によって制御されていると考えられる(Yamakoshi et al., 2012 Reproduction)。EMTは種々の成長因子により誘導されることが報告されているが、着床期の子宮内容物(分泌液)に存在するサイトカインや成長因子などがトロホブラスト細胞のEMTを誘導する可能性も示唆された。当教室では、子宮灌流液を網羅的タンパク質解析(iTRAQ法)にて子宮腔中の内容物を解析した。この解析よりアクチビンAとその阻害因子であるフォリスタチンがインターアクションにより胚のEMTを経時的に調節していることを示した(Kusama et al., 2016 Mol Cell Endocrinol)。さらに、胚と子宮の接着により転写因子OVOL2の発現が変化することに起因して、EMTが誘導されることも明らかにした(Bai et al., 2018 FASEBJ)。これらの結果から、ウシ・トロホブラスト細胞の接着性獲得には、着床期特異的な子宮腔内環境によるEMT特異的遺伝子発現の誘導が寄与していると考えられる。
胚トロホブラスト細胞の融合機構の解明
トロホブラストの融合と内在性レトロウイルス
胎盤には複数の核をもつトロホブラスト細胞(syncytium,合胞体)が存在する。げっ歯類以外の動物での複数の核の存在は細胞融合によることが知られていた。内在性レトロウイルス(Endogenous
Retroviruses, ERVs)はレトロトランスポゾン遺伝子群に属し、それ自身が転写・複製能を持つ遺伝子群であり、現在全ての脊椎動物に存在が確認されている。これらは進化の過程で、外因性レトロウイルス遺伝子が宿主のゲノム上に取り込まれることにより獲得されたものと考えられている。その多くは膨大な時間を経ることで、ゲノム上の様々な位置に複製・増幅され、いまやヒトでは全ゲノムの8%、マウスでは10%がレトロウイルス由来のDNAであることが分かっている。ところが、レトロウイルス由来遺伝子のほとんどは不完全な形で保存、複製されてきたため、実際にタンパク質として発現・機能することはない。しかしながら、数種類の内在性レトロウイルス由来遺伝子については多くの時間を経てもなお、元の配列が保存されている。そのうちの数種類については胎盤特異的に転写、翻訳が行われているが、その役割については不明な点が多い。近年、ヒトにおいてはHERV(Human
Endogenous Retrovirus)-Wファミリーのエンベロープ(外膜)・タンパク質に由来するsyncytin1やHERV-FRDファミリーの同じくエンベロープ・タンパク質由来のsyncytin2が細胞融合能を有していることが明らかにされ、胎盤形成初期に見られるトロホブラスト細胞同士の融合に大きな役割を果たしているのではないかと注目されている。また、syncytin様の機能をもつERVsはげっ歯類、ウサギ、イヌ、ネコや反芻動物に存在することも明らかになってきた
(Imakawa et al., 2015 Genes Cells)。
次世代シーケンサー(RNA-seq)法を用い、ウシ着床期の胚トロホブラスト細胞に発現する転写産物を同定し、それらをRetroTector法などで解析すると、転写産物の中に多数のERV由来のものが存在することが分かった。その1つのBERV-K1は胚トロホブラスト2核細胞に特異的に発現しているだけでなく、細胞融合能を有していた(Baba et al., 2011 J Viro)。そこで、BERV-K1はウシ・トロホブラスト細胞が母親の子宮上皮細胞と融合するときに機能していることが考えられた。また、別のERV遺伝子のBERV-Pの核酸配列は、イヌやネコで発見されたsyncytin様の働きをもつERVに酷似していたため、この遺伝子も細胞融合能をもつことが期待された。ところが、細胞融合能は存在しなかった(Nakagawa et al., 2013 Genome Biol Evol)。
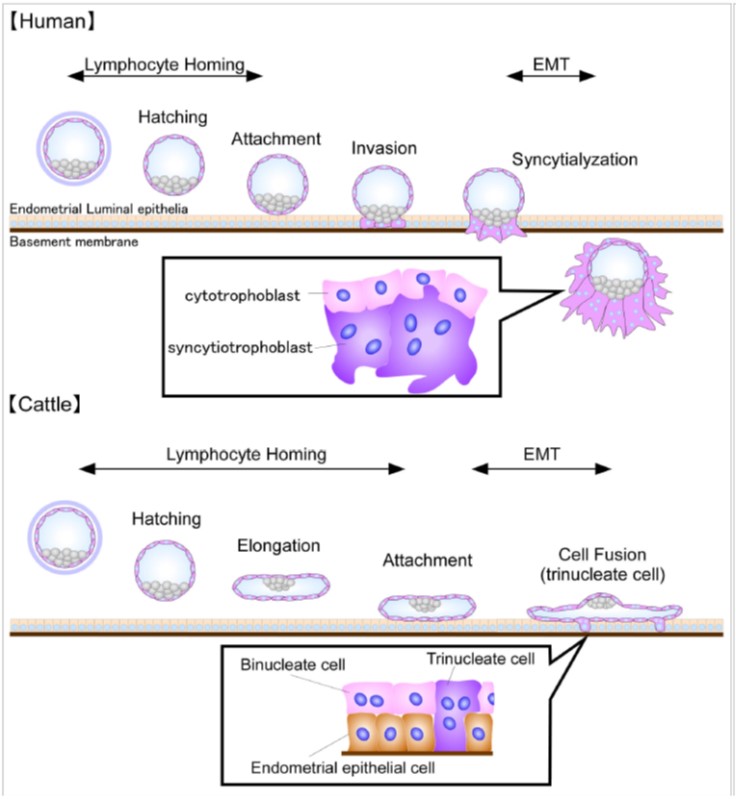
1/2/3核細胞のバイオロジー
ウシ胚トロホブラストは、胚伸長期あたりから2核細胞を形成し、子宮内膜へ接着後、子宮内膜上皮細胞と融合することで3核細胞を形成することが知られている(ヒツジでは3核ではなく多核細胞を形成)。これらの2核細胞および3核細胞をin
vitroの系で、かつ生体内と同様にトロホブラストと子宮上皮細胞を用いて作出する。さらに、1/2/3核細胞の特徴を遺伝子レベルで分類分けし、新たなマーカー因子の同定を行っている。トロホブラストの多核細胞の形成は初期胎盤の形成に重要なイベントである。故に、多核細胞への分化・融合の制御やそのマーカーによる同定が可能になれば胎盤形成機構の一端を解明でき、妊娠率向上へとつながる。
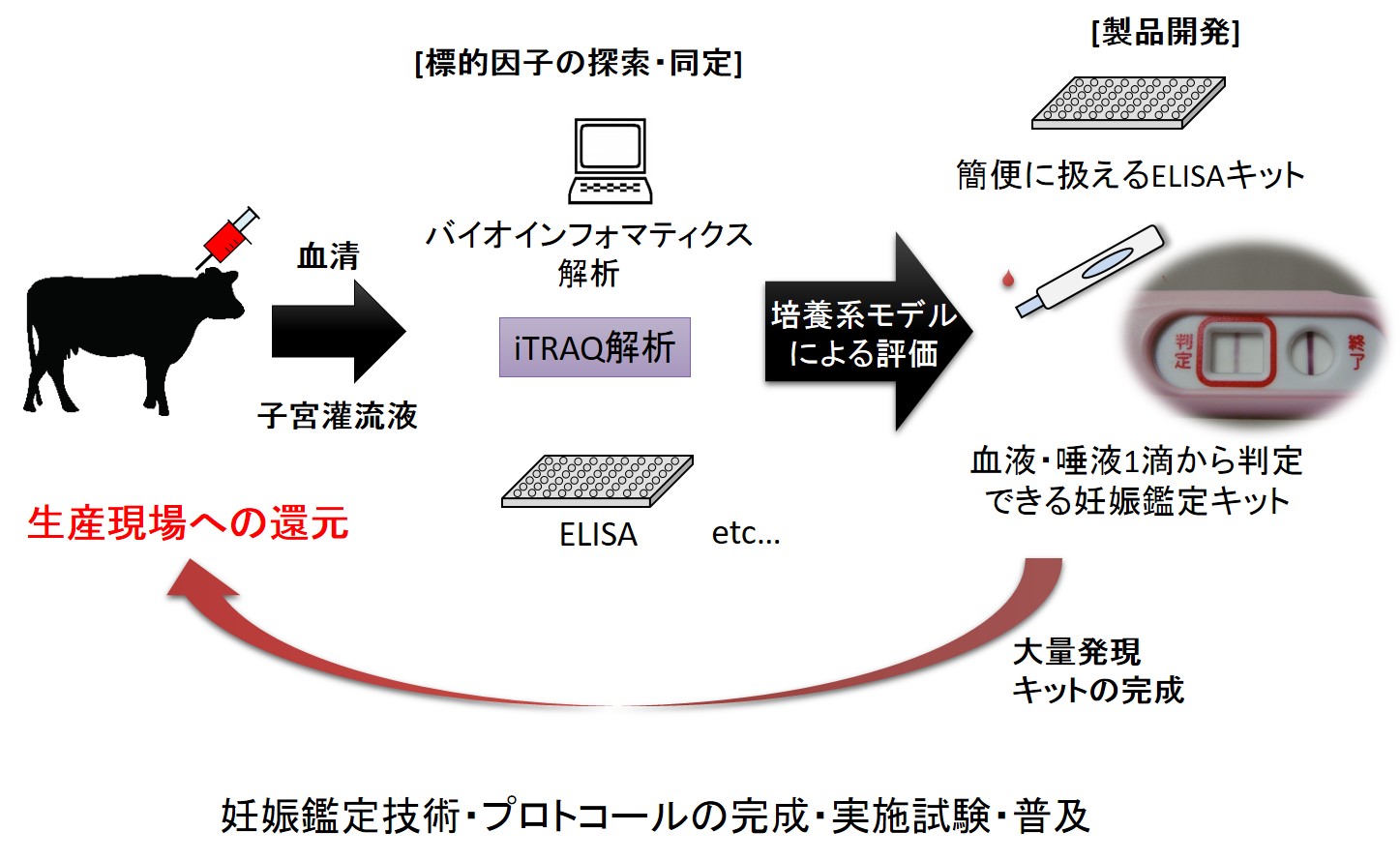
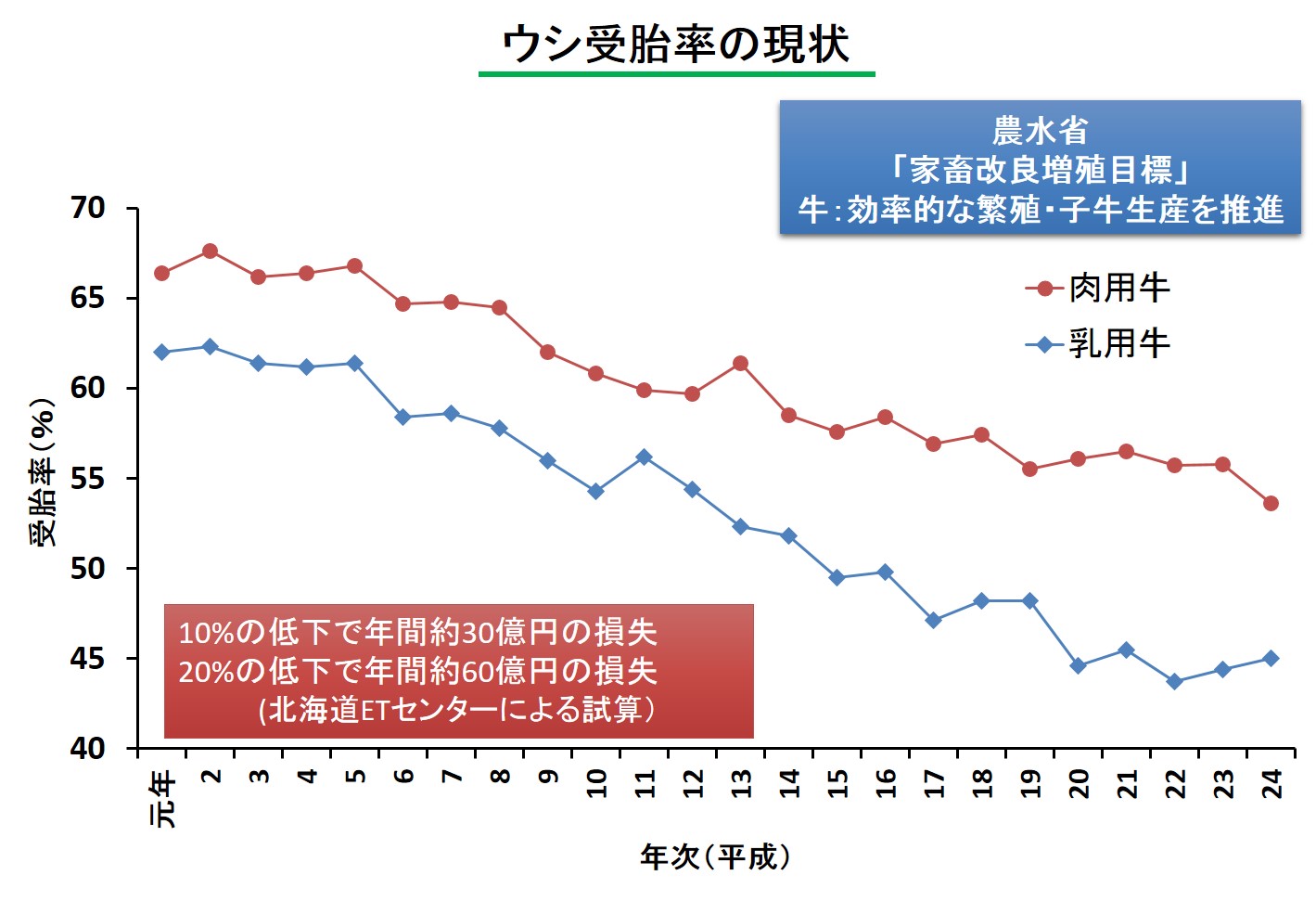
不受胎牛早期判別と分娩間隔短縮のためのマーカー探索
本邦のウシの受胎率は年々低下の一途たどっており、人工授精でも胚移植でも受胎率が50%、地域によっては40%を切るほど落ち込んでいる。胚はおもに着床を境に受胎率が大きく変わる。しかしながら、性周期の改善や発情同期化法あるいは発情鑑定法の開発だけでは、妊娠着床期における早期胚死滅による不受胎牛を改善することはできない。また不受胎牛の発見が遅れれば遅れるほど、その後の対策が遅れ結果として分娩間隔が延長される。本研究開発は一般的な妊娠鑑定剤ではなく、人工授精や胚移植後の不受胎牛の早期発見法を開発することである。本技術が開発されれば、空胎期間の短縮を行うことができるので生産コストの低減から、今後の酪農家の生産基盤を強化することとなる。受胎率10%の向上は約30億円の経済効果に貢献するだけではなく、酪農家個々の意識の高揚や自信に繋がる。
現在は、着床周辺期のウシ血液中(受胎・不受胎牛)のタンパク質と代謝産物を網羅的に解析し、不受胎牛でのみ変化がみられる因子の同定を行っている。さらに、その因子の生理的な役割の解析及び、現場で使用な可能な鑑定キットの作成を試みている。
本研究は、JRA畜産振興会の研究開発事業により行われている。
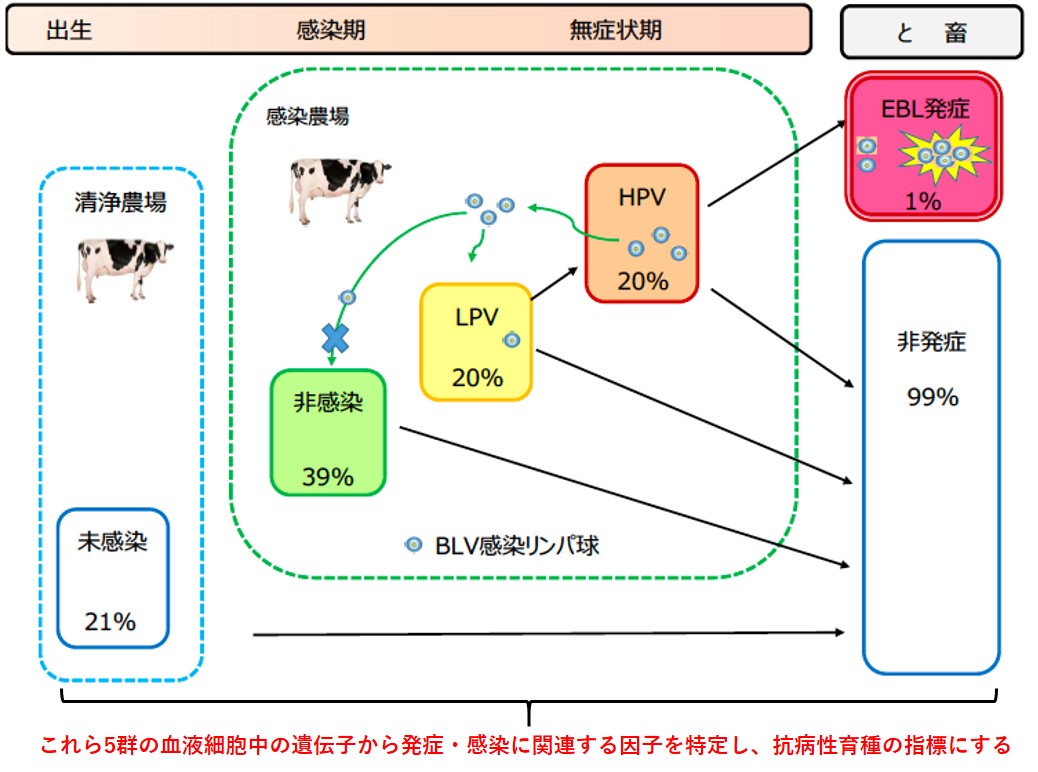
ウシ白血病抗病性育種に向けたEBL/BLV抵抗性遺伝子の探索
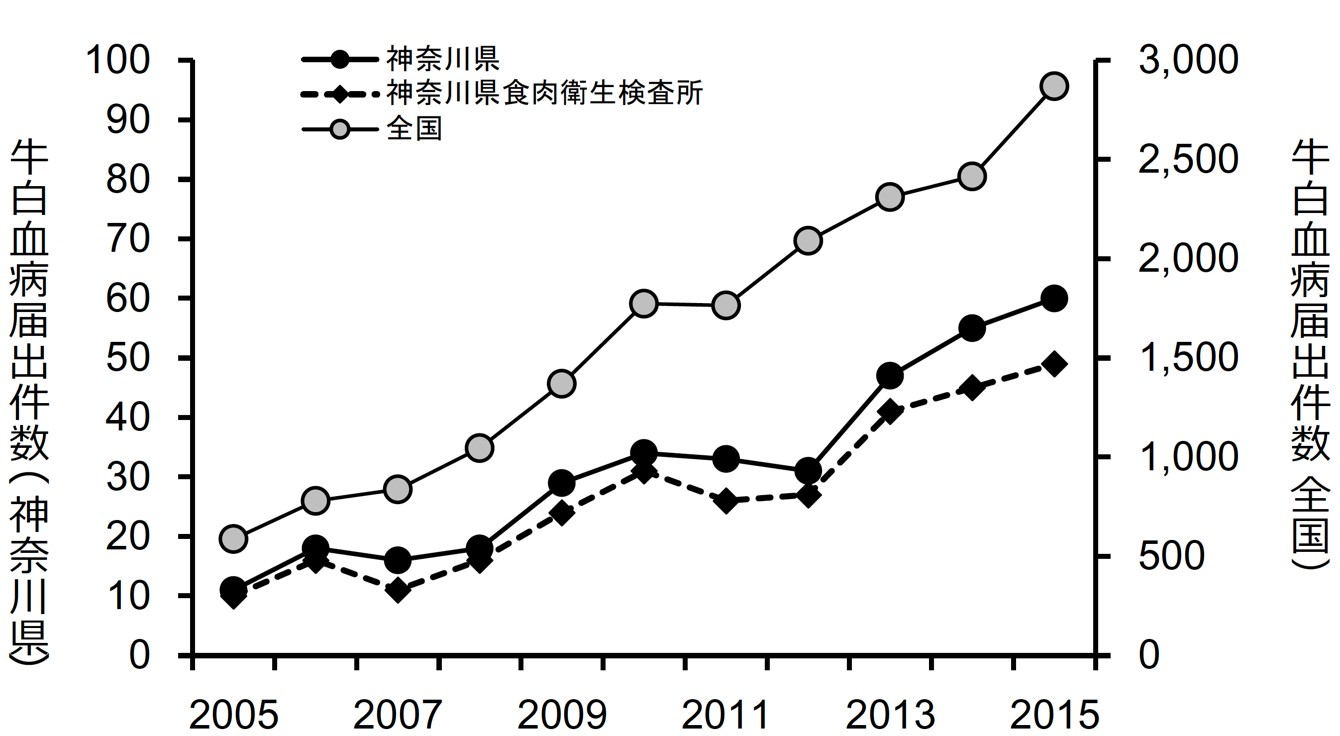
この20年、牛白血病ウイルス(BLV)の酪農場浸潤率だけではなく、個々の牛の感染率も増加の一途を辿っている。その結果、主にBLV感染に起因する牛白血病の届出頭数は平成20年に1,000頭に達し、平成27年には年間3,000頭を超え、牛白血病(EBL)発症牛は増え続けている。発症牛のほとんどが屠場発見であり、全廃棄され、少なく見積もっての年間30億円以上の損害が出ている。これにより、生産者にとっての損害は甚大なものになり生産基盤の弱体化に繋がっている。また、ワクチンなど有効な治療法は未だに開発されていない。そのため、早急な対策法の開発が必須である。
当教室では、本邦が導入している「牛個体識別番号(ID)制度」の情報を統計遺伝学的に精査し、EBL発症抵抗性のある個体および系統を特定している(稲垣et al., 2017 畜産の研究; Inagaki et al., 2017 Anim Sci J in revision)。これらの牛を特定しているにもかかわらず、BLVの感染伝播は細胞間接着によりウイルスが受け渡されることから、ウイルス感染を完全に防御するワクチンを開発することは極めて難しい。また、分子レベルでのEBL発症機構は未だ明らかにされておらず、発症予防や治療法の開発はほとんど行われていない。そこで、BLV感染・EBL発症抵抗性を示す牛に着目し、それらを育種学的に作出することを最終目標として、BLV感染およびEBL発症に抵抗性を示す牛群から特異的な遺伝子を抽出し、培養細胞により精査しながら候補遺伝子を決定し、選抜育種の指標となる因子を明らかにする。これにより、BLVの清浄化およびEBL発症の防止に繋がる。
現在の当研究室では下記の項目について研究している。
①清浄農場の未感染牛、感染農場の非感染牛、感染牛(低プロウイルス量群、高プロウイルス量群)およびEBL発症牛の末梢血の遺伝子発現の網羅的解析による感染・発症抵抗性遺伝子群の特定。
②5群のSNP解析を行い、プロウイルス量と相関関係のある有意なSNP領域及び近傍の機能遺伝子の特定
③BLV感染細胞培養試験により候補遺伝子の機能の精査と感染・発症抵抗性牛群と遺伝子型の同定